Was ist Druck?
Druck wird definiert als Kraft pro Flächeneinheit. Wie aber entsteht diese Kraft, z.B. in einem Behälter, der mit Gas gefüllt ist?
Gas besteht aus kleinen Partikeln (Molekülen und Atomen). Diese Partikel sind in dauernder Bewegung. Wenn sie irgendwo auftreffen, so üben sie dort eine Kraft aus. Wenn man eine Flächeneinheit nimmt und die Anzahl und Intensität dieser Stöße misst, so ist das eine Druckmessung.
Was ist Vakuum ?
Vakuum wird erzeugt, indem man Luft (bzw. Gas) aus einem Behälter entfernt. Es bleiben aber immer noch Partikel übrig, die ständig auf die Wandung des Behälters treffen. Es herrscht also immer noch ein Druck. Das absolute Vakuum, das praktisch nicht erreichbar ist, hätte dann den Druck "Null". Der Druck, bezogen auf das absolute Vakuum, wird Absolutdruck genannt.
Auch im Vakuum herrscht also ein Druck, wenn er auch sehr klein ist. Einen "Unterdruck" in diesem Sinne gibt es also nicht. Der Atmosphärendruck ist damit rund ein bar absolut. Manometer, die bei Atmosphärendruck Null bar anzeigen, sind "relativ" messende Instrumente. Sie zeigen den Druck relativ zum Atmosphärendruck an. Als Vakuum wird allgemein ein Druck bezeichnet, der niedriger ist als der Atmosphärendruck.
Zusammensetzung der Luft
Die Luft ist ein Gemisch von verschiedenen Gasen. Über 99 % der Luft besteht aus Stickstoff und Sauerstoff.
Der Rest sind andere Gase.
Tabelle 1
Was ist Partialdruck?
Mit Partialdruck bezeichnet man den Druck, den eine einzelne Gasart in einem Gasgemisch hat. Aus der Tabelle 1 kann man die prozentuale Zusammensetzung der Luft erkennen. Bei einem Druck von 1 bar (1000 mbar) und einem Sauerstoffgehalt von 20,95 % ist dann der Partialdruck des Sauerstoffs in der Luft = 0,2095 bar oder 209,5 mbar. So kann man die Zusammensetzung des Mischgases Luft auch in folgender Tabelle mit dem Partialdruck der einzelnen Gase sehen:
Tabelle 2
Daltons Gesetz
Daltons Gesetz erklärt die Zusammenhänge bei dem Partialdruck in Mischgasen
Dabei sollte man sich noch merken:
Ein Gasgemisch in einem geschlossenem Behälter entmischt sich nicht mehr, da die thermische Bewegung der Teilchen eine ständig neue Mischung erzeugt. Es ist also nicht so, daß bei einem Helium-Luft-Gemisch das Helium wegen des kleineren relativen Atomgewichts, sich wieder entmischt und nach oben steigt.
Was ist Gas ?
Gas ist Materie, bei der sich die Moleküle frei bewegen können. Diese Moleküle verteilen sich stets gleichmäßig im Raum, so dass überall der gleiche Druck herrscht. Bei Gasgemischen ist auch an jedem Ort des Raumes die Zusammensetzung des Gemisches die Gleiche. Es herrscht überall der gleiche Partialdruck.
Bei einem festen Stoff sind die Teilchen fixiert. Sie können nur vibrieren und rotieren. Bei einer Flüssigkeit sind die Teilchen weniger stark gebunden. Sie können aneinander gleiten, aber sich nicht voneinander lösen.
Was ist Dampf ?
Wenn eine Flüssigkeit oder ein fester Körper gasförmig wird, so nennen wir diesen Vorgang "verdampfen" bzw. "sublimieren".
Dieser Dampf kann wieder in die flüssige oder feste Phase zurückkehren.
Diesen Vorgang nennen wir "kondensieren" bzw. "resublimieren". Alle Dämpfe haben einen Sättigungsdampfdruck. Wenn der Druck in einem System höher wird als der Sättigungsdampfdruck, so kondensiert der Dampf. Umgekehrt gilt, solange noch eine Flüssigkeit in einem System vorhanden ist, kann man den Druck durch pumpen nicht unter den Sättigungsdampfdruck erniedrigen, weil ständig Flüssigkeit verdampft.
In einem Behälter, der eine Flüssigkeit und deren Dampf enthält und der Druck gleich dem Sättigungsdampfdruck ist, kann ständig Dampf kondensieren und Flüssigkeit verdampfen. Wasser und dessen Dampfdruck verdient in der Vakuumtechnik unsere besondere Beachtung, denn als Luftfeuchtigkeit kommt Wasserdampf in relativ großen Mengen vor. Wasser ist aus Vakuumsystemen recht schwierig zu entfernen.
Wir bezeichnen Dämpfe als die Gase, die bei normalen Temperaturen verdampfen oder kondensieren. Grundsätzlich können alle Gase kondensieren, es kommt nur darauf an, wie tief man sie kühlt.
Dampfdruck des Wassers bei verschiedenen Temperaturen
Tabelle 3
Dampfdruck von verschiedenen Flüssigkeiten bei 20° Celsius
Tabelle 4
Was ist freie Weglänge?
Mit mittlerer freier Weglänge bezeichnet man die Distanz, die ein Gas- oder Dampfmolekül im Durchschnitt zurücklegt, bevor es mit einem anderen Gas- oder Dampfmolekül zusammenstößt. Im Hochvakuum (bei molekularer Strömung) werden diese Distanzen so groß, dass die Gasmoleküle nur noch mit der Wandung des Gefäßes kollidieren.
30 Trillionen
3 x 1013
30 Billionen
30 Millionen
Tabelle 5
Die mittlere, freie Weglänge ist druckabhängig. Die Teilchen, die bei Atmosphärendruck alle 10tausendstel mm zusammenprallen, treffen im Mittel bei einem Druck von 10 mbar nur alle 68 km aufeinander. Die folgende Formel zeigt die mittlere, freie Weglänge für Luft bei 20 C.
Die mittlere, freie Weglänge verschiedener Gase bei 20 Grad Celsius und verschiedenen Drücken
Avogadro's Gesetz
Was ist ein Mol?
Das mol ist ein Maß für die Stoffmenge.
Warum nimmt man gerade für 1 mol das Volumen von 22,415 Litern, um die Anzahl der Gasteilchen zu bestimmen ?
Weil dann das Gewicht des Gases gleich seiner relativen Atom- oder Molekülmasse ist.
Beispiel: 1 mol Helium = 22,415 Liter wiegen (bei 0°C und 1,013 bar) 4 Gramm.
Bleiben wir beim Beispiel Helium:
In einem Kubikzentimeter befinden sich dann (wieder bei NTP d.h. bei Normdruck = 1,013 bar und bei Normtemperatur von 0°C):
Beispiel: Wenn man ein Vakuum mit einem Druck von 10 mbar erzeugt, also 100 mal kleiner als 1 bar, so sind in diesem Vakuum pro Kubikzentimeter immer noch 2,69 x 1019 Teilchen, d.h.:
Mengengrößen
Es gibt verschiedene Mengengrößen, wie in der folgenden Tabelle gezeigt:
Die relative Molekülmasse
Früher bezeichnete man diese Verhältnisse als "Atomgewicht" bzw. als "Molekulargewicht". Diese Bezeichnungen sind irreführend, weil es sich nicht um Gewichte, sondern um Verhältniszahlen handelt. Die relative Molekülmasse M (auch Molmasse oder molare Masse genannt) in SI-Einheiten ist definiert in kg/kmol. In Formeln eingesetzt ist dann die relative Molekülmasse von Helium:
Boyle's Gesetz
Wenn man das Volumen eines Gases verkleinert (z.B. durch einen Kolben zusammenpresst), so erhöht sich der Druck in gleichem Maße, wenn die Temperatur dabei konstant bleibt. Halbiert man das Volumen, so verdoppelt sich der Druck.
auch bekannt als:
Wenn man Vakuum erzeugt, also den Druck sehr stark erniedrigt, dann expandieren Gase zu enormen Volumen (entsprechend Boyle's Gesetz). Dies geschieht auch mit absorbiertem Gas, z.B. aus Fingerabdrücken oder Schmutz.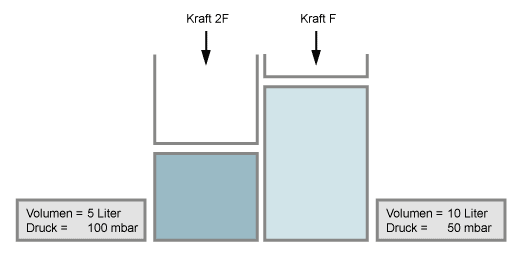
bei gleicher Anzahl von Molekülen (Temperatur konstant gehalten)
Charles Gesetz
Das Volumen eines Gases verändert sich mit der Temperatur. Wird das Gas kälter, verringert es sein Volumen; wird es wärmer, so dehnt es sich aus.
Wenn sich die Temperatur verdoppelt, so verdoppelt sich auch das Volumen, vorausgesetzt der Druck bleibt konstant.
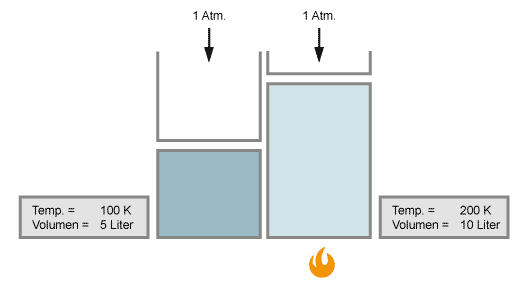
Untersucht man Charles' Gesetz noch genauer, so gelangt man zu einer noch genaueren Beziehung zwischen Gasvolumen und Temperatur, dem Gesetz von Gay-Lussac:
Das Gesetz von Gay-Lussac
Wenn die Temperatur eines Gases sich von 0 Grad Celsius um 1 Grad nach oben oder unten verändert, so vergrößert oder vermindert sich sein Volumen um 1/273stel seines ursprünglichen Wertes.
Lord Kelvin gelangte über dieses Gesetz zu seiner Skala für die absolute Temperatur.
Zusammenfassung:
Fasst man nun diese drei Gesetze zusammen, so gelangt man zum allgemeinen Gasgesetz:
Das allgemeine Gasgesetz
ν(Ny) ist das Einheitszeichen für die Stoffmenge in mol bzw. kmol
Das allgemeine Gasgesetz unterliegt keiner Einschränkung, wie die Gesetze von Charles, Boyle und Avogadro.
Die Temperaturen in Charles' Gesetz und im allgemeinen Gasgesetz werden in Kelvin eingesetzt.
Die allgemeine Gaskonstante
1 J (Joule) = 1 Nm = 1 Ws
Für Berechnungen werden häufig zweckmäßig die folgenden äquivalenten Werte benutzt:
Individuelle Gaskonstanten
Teilt man die allgemeine Gaskonstante durch die relative Molekülmasse (molare Masse) des entsprechenden Gases, so erhält man die individuelle Gaskonstante Ri:
Tabelle 6
Wenn man Berechnungen mit einem bestimmten Gas durchführen will, so benutzt man das allgemeine Gasgesetz mit der individuellen Gaskonstanten Ri.


